|
研究テーマ
貴重な有機資源を環境に調和した手法で効率的に分子変換し、有用な有機物質・有機分子へと変換する新しい反応を開発することは現代の有機化学において極めて重要です。当研究室では、有機合成化学・有機金属化学を基盤として、高効率的な分子変換を可能にする新しい有機遷移金属錯体を設計し、これを活用する環境調和型物質変換反応の開発に取り組んでいます。現在は、遷移金属として主にイリジウム等の9族金属をとりあげ、有機分子における様々な結合切断ならびに結合形成を経るグリーン触媒系の開発や、高度な分子変換を可能にする高活性触媒・高機能性配位子の探索、さらにこれを活用する可逆的有機ヒドリド系水素貯蔵システムの開発に関する研究を行っています。
1.イリジウム錯体触媒を用いた水素移動反応を基軸とする低環境負荷型(グリーン)分子変換・触媒系の開発
水素移動反応は、有機分子間で水素原子をやり取りする酸化・還元反応をもとに分子変換を達成するものであり、多くの場合1)毒性の高い酸化還元試剤を用いなくてすむ、2)反応をおだやかな条件で行うことができる、3)反応に伴って発生する有害な廃棄物が少ない、等の利点があります。当研究室ではCp*(ペンタメチルシクロペンタジエニル)配位子を持つイリジウム錯体が、有機分子間の水素移動過程において高い触媒活性を発現することを見出し、これを活用するグリーン触媒系を開発してきました。
最初に、[Cp*IrCl2]2を触媒に用いる水素移動型酸化反応(Oppenauer型酸化反応)を開発しました(式1-1)。この反応は、害の小さいアセトンを水素受容体に用いて、室温条件下でのアルコールの酸化によってアルデヒドやケトンを選択的に得ることのできる反応です。
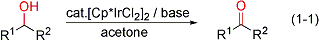
また、有機ハロゲン化合物を用いないアミンや含窒素複素環合成の新触媒系を見出しました(式1-2, 1-3)。これらの反応は共生成物が水のみという点に特長があり、原子効率の高い反応であるといえます。入手が容易で害の小さいアルコールやジオールを原料に用いていることも特長です。本研究の内容はGreen Chemistry誌のハイライト記事として紹介されました(Green. Chem. 2004, 6, G76)。

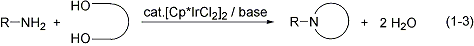
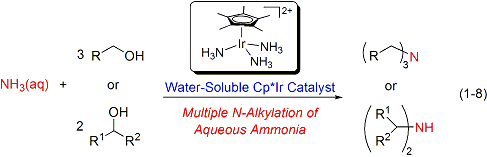
アンモニウム塩を窒素源として利用できる、効率性・環境調和性の極めて高いアミン合成触媒系の開発にも成功しました(式1-4)。この触媒反応は無溶媒で進行し、アンモニウム塩の種類を変えるだけで第三級アミンと第二級アミンを選択的に作り分けることができます。また、アンモニウム塩とジオールとの反応によって合成価値の高い環式第二級アミンを収率良く合成することにも成功しています(式1-5)。これらの研究内容はSynfacts誌のハイライト記事としてとりあげられました(Synfacts 2008, 4, 407)。
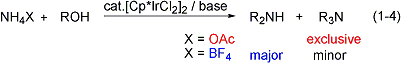
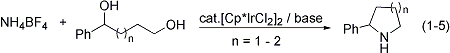
アミンやアンモニウム塩以外にも、カルバミン酸エステル類、カルボン酸アミドやスルホンアミド類を環境調和性の高い反応によって窒素原子上にアルキル基を導入する触媒系も開発しました(式1-6, 1-7)。
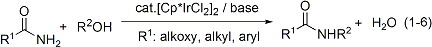
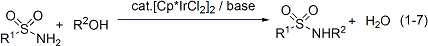
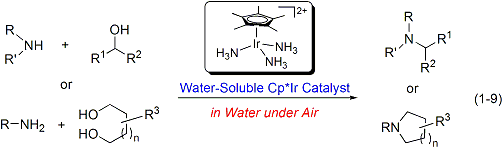
さらにごく最近には、水に易溶かつ水中で安定なCp*イリジウム-アンミン錯体を開発し、安価で取り扱いの容易なアンモニア水を窒素源としアルコールをアルキル化剤に用いるアミン合成触媒系の構築に成功しました(式1-8)。また、この水溶性触媒を用いることで、低級アミンのアルキル化による高級アミンや環式アミンの合成を空気雰囲気下水中で行うことができ、触媒を繰り返し再利用することも可能です(式1-9)。
上記の炭素-窒素結合生成反応だけでなく、炭素-炭素結合生成反応も開発しました。第二級アルコールと第一級アルコールとの反応によって、通常は多段階を経ねばならないβ-アルキル化反応が一度の反応で達成できます(式1-10)。
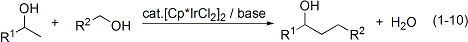
Cp*イリジウム錯体は移動水素化還元の触媒となることもわかりました。キノリン誘導体の移動水素化を取り扱いやすい2-プロパノールを水素源に用いて行うことができます(式1-11)。
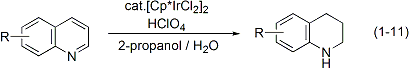
イリジウムと同族のロジウムも高い水素移動触媒活性を持つことがわかりました。アミノアルコールを原料とする環式アミドの合成(式1-12)やアルコールを水素源とする含塩素芳香族化合物の脱塩素化反応(式1-13)も開発しました。
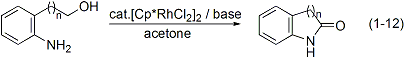
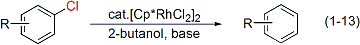
2.高度分子変換を達成する高活性触媒の設計と高機能性配位子の探索
有機分子変換反応の開発において、高い触媒活性や高度な環境調和性を達成するためには、触媒分子内の配位子の電子的・立体的性質を考察して緻密に設計することが欠かせません。当研究室では、様々な性質を有する新しい有機配位子をもつ遷移金属錯体分子を合成し、その構造をX線解析等によって明らかにするとともに、触媒として応用しています。
Cp*イリジウム錯体に含窒素複素環カルベン配位子を導入した新規錯体について合成しました。この配位子の導入により、水素移動反応における触媒活性が十数倍向上することが明らかになりました(式2-1)。
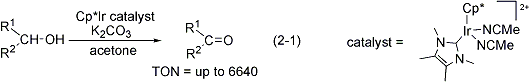
酸化剤をまったく必要としないでアルコールの酸化を達成できる新しい錯体触媒の創製・開発にも成功しました(式2-2)。機能性配位子として2-ヒドロキシピリジンを導入したCp*イリジウム錯体を触媒に用いることで、第二級アルコールの脱水素化反応が速やかに進行し、水素ガスの発生を伴ってケトンが得られます。
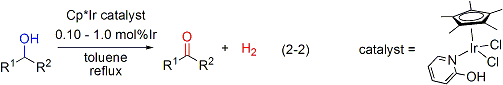
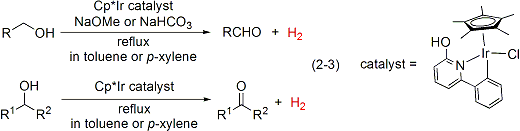
次に、C,N-キレート構造を有する機能性ピリジン系配位子を導入したCp*イリジウム錯体触媒を用いることで、第一級アルコールと第二級アルコールの両方を脱水素的に酸化してアルデヒドやケトンへと効率的に変換する触媒系も開発しました。(式2-3)。
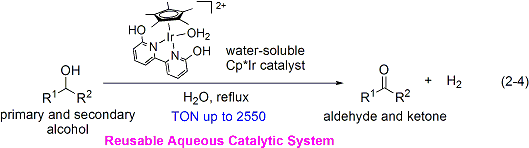
さらに、機能性ビピリジン系配位子を有する新規水溶性Cp*イリジウム錯体を設計し、第一級および第二級アルコールの脱水素的酸化反応を水中で行うことにも成功しました。(式2-4)。この触媒系は、反応終了後に簡単な操作で触媒を回収し、何度も再利用できることも特長です。
この水溶性Cp*イリジウム錯体触媒を用いることによって、各種ジオール類の脱水素的環化によるラクトン合成反応が水溶媒中で達成されました。(式2-5)。
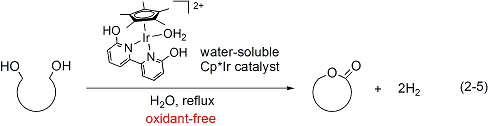
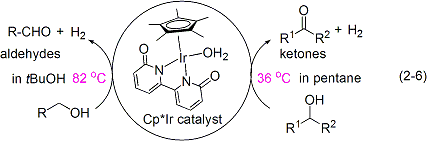
最近には、機能性ビピリドナート配位子を持った新しいCp*イリジウム錯体触媒を開発し、これまでに例のない穏やかな条件下でのアルコールの脱水素的酸化反応を実現しました。(式2-6)。
3.均一系高機能性錯体触媒を活用する可逆的有機ヒドリド系水素貯蔵システムの開発
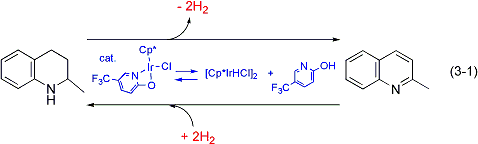
高活性な水素移動錯体触媒を発展させ、有機分子の脱水素化と水素化の両方を可逆的に効率よく行う触媒系の開発に取り組んでおり、水素貯蔵システムとしての応用を検討しています。現在までに、キノリンとテトラヒドロキノリンとを水素化/脱水素化によって相互変換し、水素の貯蔵と放出を達成する新しい可逆的触媒システムを開発しました(式3-1)。本システムは、劣化することなく水素の貯蔵と放出を5回以上繰り返すことができます。また、脱水素化と水素化における触媒種が、系内の水素の有無に応じて相互変換していることを明らかにしており、極めて興味深い触媒システムといえます。本研究の内容はNature Chemistry誌の"news & views"にてハイライト記事として紹介されています(Nature Chem. 2009, 1, 350)。さらに、その他の有機分子を用いた有機ヒドリド系水素貯蔵システムの開発や、より高機能な錯体触媒の開発について研究を行っています。
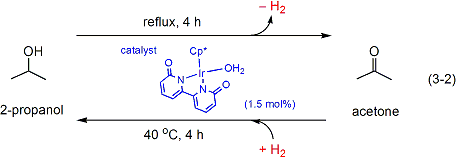
ごく最近には、2-プロパノールとアセトンとの間の脱水素化/水素化に基づいた相互変換による水素貯蔵システムの原型の構築にも成功しています。(式3-2)。
4.銅/機能性配位子からなる新規触媒系を活用する酸化的カップリング反応の開発
最近、比較的安価な銅化合物を触媒に用いる有機合成反応に注目が集まっています。当研究室では、入手が容易な銅(Ⅰ)ハロゲン塩と2-ヒドロキシピリジン系の機能性配位子とを組み合わせることで、有機分子の酸化的カップリングの良好な触媒となることを見出しました。例えば、アゾール類のC-H結合ホモカップリング反応が、空気を酸化剤として高収率で進行します(式4-1)。
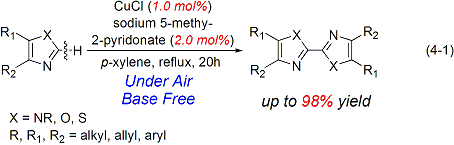
さらに、アルデヒド類と第二級アミン類との反応を空気中で行うことによる、原子効率に優れたアミド合成を銅触媒を用いて達成しました。(式4-2)。

5.複数の金属から成る新しい有機金属錯体の創製とその機能の解明
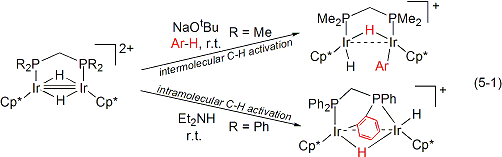
遷移金属錯体を触媒に用いる有機合成反応が近年数多く開発され、有機合成化学に大きく貢献していますが、そのほとんどは単核金属錯体が触媒活性種として機能し進行するものです。一方、ひとつの分子内に二つ以上の遷移金属中心を有する複核錯体は、複数の金属による基質の多中心的活性化や複数の基質の同時活性化等の協同作用により、単核金属錯体が与える反応場では実現し得ない新しい機能の発現が期待されています。当研究室では、この考えのもと、イリジウムを中心とした新しい有機金属複核錯体の設計、合成とその機能解明について研究しています。最近の研究成果として、二核イリジウム錯体上で、本来反応不活性なベンゼン環の炭素-水素結合が容易に切断されることを明らかにしました(式5-1)。
|



